Wichtig: Retatrutide ist ein Pruefarzneimittel. Die europaeische Arzneimittelbehoerde (EMA) hat Retatrutide zum 19. Februar 2026 nicht fuer die allgemeine Verschreibung zugelassen. Mehr erfahren
Retatrutide kaufen
Veyvora Retatrutide Pens
Veyvora verkauft Retatrutide-Peptid-Pens in Europa. Diese Seite erklaert, was Retatrutide ist, was klinische Studien zeigen, wie die Dosierung in Studien erfolgte, wie das Pen-System funktioniert und was Kaeufer vor dem Kauf wissen sollten.
Letzte Aktualisierung: 19. Februar 2026
Wichtige Erkenntnisse
- •Retatrutide ist ein dreifacher Hormonrezeptor-Agonist, der GLP-1-, GIP- und Glukagon-Rezeptoren aktiviert.
- •Eine Phase-2-Studie, veroeffentlicht am 26. Juni 2023 im New England Journal of Medicine, berichtete ueber bis zu 24,2 % mittlere Gewichtsreduktion nach 48 Wochen bei der hoechsten untersuchten Dosis.
- •Gastrointestinale Nebenwirkungen wie Uebelkeit und Erbrechen traten bei hoeheren Dosen haeufiger auf.
- •Retatrutide ist in der EU nicht zugelassen fuer die Routineverschreibung.
- •Veyvora liefert Retatrutide-Pens mit Chargendokumentation und europaeischem Versand.

Retatrutide-Gewichtsverlust: Fortschrittsberichte europaeischer Kunden
Die folgenden Berichte wurden freiwillig von Veyvora-Kunden eingereicht. Individuelle Ergebnisse variieren je nach Ausgangsgewicht, Einhaltung, Ernaehrung und Bewegung. Diese Berichte stellen keine medizinische Beratung dar und garantieren keine spezifischen Ergebnisse.
14-22 %
Selbstberichtete Reduktion
12-24 Wo.
Typische Dauer
Woechentlich
Dosierungsplan
CoA
Chargenverifiziert
Stetige Reduktion ueber drei Monate
Ein 36-jaehriger maennlicher Kunde aus Muenchen berichtete ueber eine konstante Gewichtsreduktion waehrend eines 12-Wochen-Zeitraums mit Veyvora Retatrutide-Pens bei einer titrierten Dosis. Er kombinierte das Protokoll mit einem moderaten Kaloriendefizit und drei woechentlichen Krafttrainingseinheiten. Seine selbstberichteten Messungen zeigten fortschreitende Veraenderungen des Bauchumfangs und des Gesamtkoerpergewichts. Er bemerkte reduzierten Appetit ab der zweiten Woche und leichte Uebelkeit in der ersten Woche jeder Dosissteigerung.
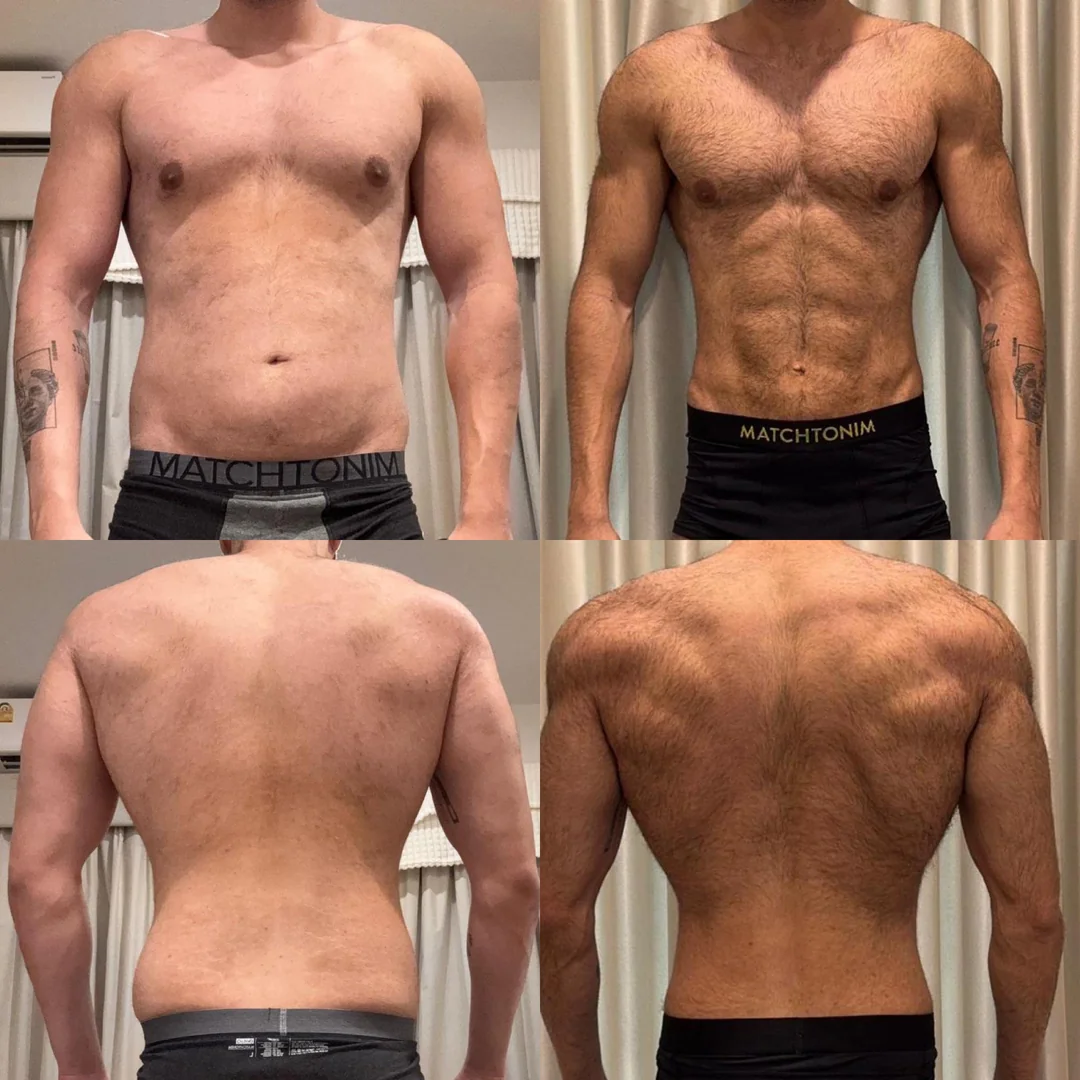
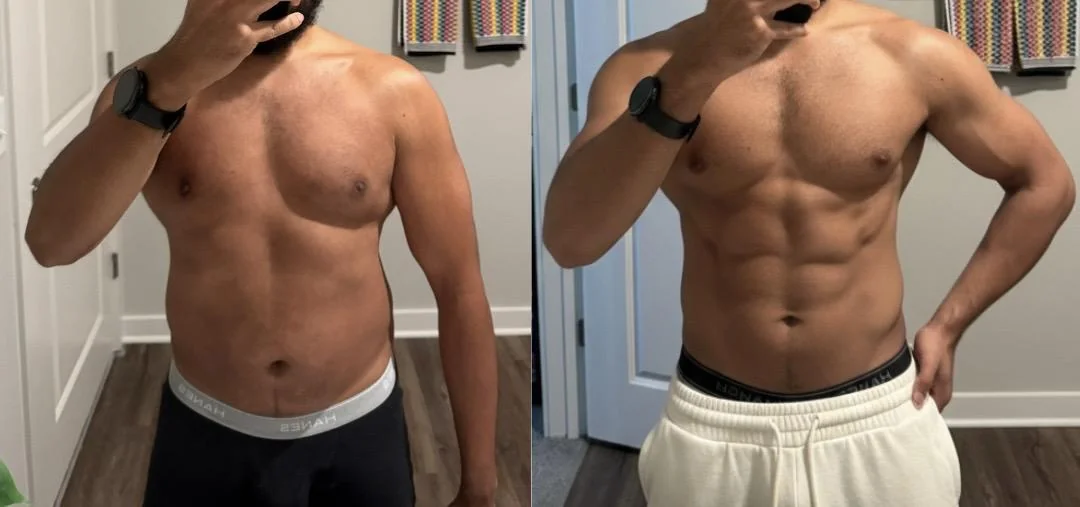
Erweitertes Protokoll mit Koerperrekomposition
Ein 31-jaehriger maennlicher Kunde aus Hamburg dokumentierte seine Erfahrung ueber einen 24-Wochen-Zeitraum. Er folgte einem strukturierten Trainingsprogramm neben dem Retatrutide-Protokoll mit einer taeglichen Proteinaufnahme ueber 2 g/kg. Seine freiwillig eingereichten Fortschrittsfotos zeigen Veraenderungen in der sichtbaren Muskeldefinition neben Fettreduktion. Er berichtete, dass die Appetitkontrolle am staerksten in den Wochen 4 bis 16 spuerbar war, mit leichten gastrointestinalen Beschwerden waehrend der anfaenglichen Titrationsphase.
Wie vergleichen sich diese Berichte mit klinischen Studiendaten?
In der Phase-2-NEJM-Studie (Jastreboff et al., 2023) erreichten Teilnehmer mit 12 mg Retatrutide eine mittlere Koerpergewichtsreduktion von 24,2 % nach 48 Wochen unter kontrollierten Bedingungen. Selbstberichte von Kunden erfolgen nicht unter klinischer Aufsicht und sollten nicht direkt mit den Ergebnissen begutachteter Studien verglichen werden. Variablen wie Ernaehrung, Bewegung, Ausgangs-BMI und Begleitmedikationen beeinflussen individuelle Ergebnisse.
Lesen Sie die vollstaendige klinische Evidenz zu Retatrutide, einschliesslich Phase-2-Studienmethodik und Dosis-Wirkungs-Daten, in unserer ausfuehrlichen Forschungszusammenfassung.
Forschungs- und regulatorische Informationen anzeigenWichtig: Erfahrungsberichte und Fortschrittsberichte werden freiwillig von Kunden eingereicht und spiegeln individuelle Erfahrungen wider. Veyvora verifiziert Gewichts- oder Koerperkompositionsangaben nicht unabhaengig. Retatrutide ist ein investigatives Peptid, das von der EMA zum Februar 2026 nicht fuer die klinische Routineanwendung zugelassen ist. Diese Berichte stellen keine medizinische Beratung dar. Konsultieren Sie einen qualifizierten Arzt vor der Verwendung eines Peptidprodukts.





Veyvora Retatrutide Pen
Retatrutide-Peptid-Pen mit Chargendokumentation und Analysezertifikat. Dreifach-Hormonrezeptor-Agonist, der GLP-1-, GIP- und Glukagon-Rezeptoren aktiviert.
Kostenloser EU-Versand | Chargendokumentation enthalten | Preis richtet sich nach Herstellungscharge und Staerke
Veyvora verkauft Retatrutide-Peptid-Pens in Europa. Retatrutide ist ein investigativer Dreifach-Agonist, der GLP-1-, GIP- und Glukagon-Rezeptoren aktiviert. Eine Phase-2-Studie im New England Journal of Medicine berichtete ueber bis zu 24,2 % mittlere Gewichtsreduktion nach 48 Wochen. Jeder Pen enthaelt Chargendokumentation.
Vorteile der Veyvora Retatrutide Pens
Erfahren Sie, was Retatrutide basierend auf klinischen Studiendaten bietet und was Veyvora mit jeder Bestellung liefert.
Aktiviert GLP-1-, GIP- und Glukagon-Rezeptoren gleichzeitig und unterscheidet sich damit von Einzel- und Dual-Agonisten.
Bis zu 24,2 % mittlere Gewichtsreduktion nach 48 Wochen bei der hoechsten untersuchten Dosis in einer randomisierten, placebokontrollierten Studie (NEJM 2023).
Veyvora Retatrutide-Pens enthalten Chargendokumentation und Analysezertifikat pro Charge.
Die Glukagon-Rezeptor-Aktivierung erhoeht den Energieverbrauch durch Stimulation der hepatischen Glukoseproduktion und Fettoxidation.
Klinische Evidenz veroeffentlicht in peer-reviewed Fachzeitschriften einschliesslich The New England Journal of Medicine.
Versand innerhalb Europas mit sicherer Verpackung und Chargendokumentation.
Bereit, Retatrutide in Europa zu kaufen?
Produktstaerke pruefen, regulatorisches Verstaendnis bestaetigen und sicher auschecken. Chargendokumentation und Analysezertifikat bei jeder Bestellung enthalten.
Was zeigen klinische Studien?
Eine randomisierte, doppelblinde, placebokontrollierte Phase-2-Studie, veroeffentlicht im New England Journal of Medicine am 26. Juni 2023, untersuchte Erwachsene mit Adipositas oder Uebergewicht. Nach 48 Wochen: 8-mg-Dosis erreichte 21,6 % mittlere Gewichtsreduktion, 12-mg-Dosis erreichte 24,2 %, und Placebo erreichte 2,1 %.
Quelle: Jastreboff AM et al. "Triple-Hormone-Receptor Agonist Retatrutide for Obesity." NEJM, 2023.
Bahnbrechende Phase-2-Studie mit bis zu 24,2 % Koerpergewichtsreduktion mit Retatrutide ueber 48 Wochen.
Vollstaendige Studie lesenUmfassende Analyse des dreifachen Hormonmechanismus von Retatrutide und seiner ueberlegenen Wirksamkeit.
Vollstaendige Studie lesenLaufende Phase-3-Studie zur Bewertung der Langzeitwirksamkeit und -sicherheit von Retatrutide.
Vollstaendige Studie lesenOffizielles klinisches Entwicklungsprogramm von Eli Lilly fuer Retatrutide.
Vollstaendige Studie lesenDetaillierte pharmakologische Analyse des Wirkmechanismus von Retatrutide und seiner metabolischen Effekte.
Vollstaendige Studie lesenWelche Risiken wurden beobachtet?
Hoehere Dosen erhoehten gastrointestinale Nebenwirkungen. Teilnehmer berichteten ueber Uebelkeit, Erbrechen und Durchfall. Dosissteigerung reduzierte fruehe Unvertraeglichkeit. Allerdings erhoehten sich die Abbruchquoten bei hoeheren Dosen. Langfristige kardiovaskulaere Outcome-Daten sind noch nicht veroeffentlicht.
Alle referenzierten Studien wurden von unabhaengigen Forschungseinrichtungen durchgefuehrt. Retatrutide befindet sich derzeit in der klinischen Entwicklung und ist nur fuer Forschungszwecke verfuegbar.
Veyvora Retatrutide Pen: Schritt-fuer-Schritt-Anleitung
Der Veyvora Retatrutide-Pen ermoeglicht praezise subkutane Dosierung ueber ein vorgefuelltes Mehrdosen-Pen-System. Retatrutide wird in klinischen Studien einmal woechentlich verabreicht. Befolgen Sie diese vier Schritte fuer korrekte Vorbereitung, Injektion und Nachbehandlung. Konsultieren Sie immer einen Arzt vor der Anwendung.

Bewahren Sie den Veyvora Retatrutide-Pen bei 2–8°C im Kuehlschrank auf, wenn er nicht verwendet wird. Nicht einfrieren. Vor jeder Injektion den Pen aus dem Kuehlschrank nehmen und ca. 15–30 Minuten auf Raumtemperatur bringen lassen. Die Injektion kalter Peptidloesung kann das Unbehagen an der Injektionsstelle erhoehen. Pruefen Sie vor dem ersten Gebrauch das Verfallsdatum und die Chargennummer anhand des beiliegenden Analysezertifikats.
Haende gruendlich waschen. Pen-Kappe entfernen und eine neue, sterile Pen-Nadel durch Aufschrauben auf die Pen-Spitze befestigen. Aeussere und innere Nadelkappe entfernen. Zum Entlueften eine kleine Testdosis gemaess Pen-Anleitung einstellen und den Injektionsknopf mit nach oben gerichteter Nadel druecken, bis ein Tropfen Loesung an der Nadelspitze erscheint. Das Entlueften bestaetigt die korrekte Pen-Funktion und entfernt Luft aus der Patrone. Nadeln nie zwischen Injektionen wiederverwenden.

Dosiswaehler auf die verschriebene Menge einstellen. In Phase-2-Studien, veroeffentlicht im New England Journal of Medicine (Jastreboff et al., 2023), wurde Retatrutide einmal woechentlich subkutan verabreicht. Empfohlene Injektionsstellen: Bauch (mindestens 5 cm vom Nabel), Oberschenkelvorderseite oder Oberarmrueckseite. Injektionsstellen woechentlich wechseln, um Lipodystrophie-Risiko zu reduzieren. Haut an der gewaehlten Stelle zusammendruecken, Nadel im 90-Grad-Winkel einfuehren, Injektionsknopf vollstaendig druecken und 5–10 Sekunden halten.

Nach der Injektion die aeussere Nadelkappe mit der Einhandtechnik vorsichtig wieder aufsetzen, um Nadelstichverletzungen zu vermeiden. Gebrauchte Nadel abschrauben und in einem zugelassenen Abwurfbehaelter entsorgen. Nadeln nicht im Hausmuell entsorgen. Pen-Kappe wieder aufsetzen und Pen sofort in den Kuehlschrank zuruecklegen. Injektionsdatum, Dosis und Stelle in einem persoenlichen Protokoll festhalten fuer konsistente woechentliche Anwendung. Jeder Veyvora-Pen enthaelt Chargendokumentation fuer Ihre Unterlagen.
Retatrutide-Dosierung in klinischen Studien
In Phase-2-Studien folgten Teilnehmer einem schrittweisen woechentlichen Dosissteigerungsprotokoll. Startdosen lagen typischerweise bei 1 mg woechentlich, mit Erhoehung alle vier Wochen bis zum Erreichen von 8 mg oder 12 mg. Schrittweise Titration reduzierte gastrointestinale Nebenwirkungen. Schnelle Steigerung erhoehte Uebelkeit und Abbruchquoten. Diese Information dient ausschliesslich dem Bildungszweck.
Startdosis (Studien)
1 mg
Einmal woechentlich, subkutan
Steigerungsintervall
4 Wochen
Zwischen Dosissteigerungen
Zieldosen (Studien)
8-12 mg
Hoechste untersuchte Dosen
Kurzreferenz-Injektions-Checkliste
Vor der Injektion
- 1. Verfallsdatum pruefen und Charge mit Analysezertifikat abgleichen
- 2. Pen aus dem Kuehlschrank nehmen; 15-30 Minuten auf Raumtemperatur bringen
- 3. Haende waschen und neue sterile Pen-Nadel anbringen
- 4. Pen entlueften bis ein Tropfen Loesung an der Nadelspitze erscheint
Injektion und Nachbehandlung
- 5. Verschriebene Dosis einstellen und saubere Injektionsstelle waehlen (Bauch, Oberschenkel oder Oberarm)
- 6. Haut zusammendruecken, im 90-Grad-Winkel injizieren, Knopf 5-10 Sekunden halten
- 7. Nadel in zugelassenem Abwurfbehaelter entsorgen
- 8. Pen bei 2-8 C lagern und Datum, Dosis und Injektionsstelle protokollieren
Regulatorischer und Sicherheitshinweis
Retatrutide ist ein Pruefarzneimittel. Die europaeische Arzneimittelbehoerde (EMA) hat Retatrutide zum 19. Februar 2026 nicht fuer die allgemeine Verschreibung zugelassen. Gastrointestinale Nebenwirkungen einschliesslich Uebelkeit, Erbrechen und Durchfall wurden bei hoeheren Dosen in klinischen Studien berichtet. Langfristige kardiovaskulaere Outcome-Daten sind noch nicht veroeffentlicht. Konsultieren Sie immer einen qualifizierten Arzt vor der Anwendung eines Peptidprodukts.
Verifizierte Veyvora-Kundenbewertungen aus ganz Europa
Feedback direkt von europaeischen Kunden zu Bestellung, Lieferung, Verpackung und Produktqualitaet. Individuelle Erfahrungen koennen variieren.
"Pen kam am naechsten Tag in isolierter Verpackung an. Das Analysezertifikat stimmte mit der Chargennummer auf dem Etikett ueberein. Keine Probleme beim Bestellvorgang."
Berlin, DE
1 Pen bestellt, Februar 2026
"Ich habe den Kundenservice wegen Lagerungsanforderungen kontaktiert und innerhalb weniger Stunden eine klare schriftliche Anleitung erhalten. Das Produkt war bei Ankunft gekuehlt."
Muenchen, DE
Stammkunde, 3 Bestellungen seit November 2025
"Unkomplizierter Checkout. Sendungsverfolgungsnummer wurde sofort versendet. Der Pen-Mechanismus funktionierte wie beschrieben. Chargendokumentation in der Verpackung enthalten."
Hamburg, DE
2 Pens bestellt, Januar 2026
"Preise mit drei anderen Anbietern verglichen. Veyvora bot die transparenteste Aufschluesselung und lieferte Testergebnisse Dritter ohne gesonderte Anfrage."
Koeln, DE
Erstkunde, Dezember 2025
"Diskrete Lieferung in neutralem Paket. Der Pen war gut mit Schaumstoffeinsaetzen geschuetzt. Beiliegende Dokumentation deckte Lagerung, Handhabung und Entsorgung klar ab."
Frankfurt, DE
1 Pen bestellt, Januar 2026
"Bestellung am Samstag aufgegeben und am Dienstag erhalten. Alles war korrekt beschriftet und die Kuehlkette schien intakt. Wuerde Veyvora fuer kuenftige Bestellungen wieder nutzen."
Stuttgart, DE
1 Pen bestellt, Februar 2026
Retatrutide Pens bei Veyvora bestellen
Jede Bestellung enthaelt Chargendokumentation, Analysezertifikat und isolierte Lieferverpackung. Waehlen Sie Ihre bevorzugte Pen-Staerke und schliessen Sie den Checkout sicher ab.
Bewertungen werden freiwillig eingereicht und spiegeln individuelle Kundenerfahrungen mit Bestellung, Lieferung und Produktqualitaet wider. Veyvora bearbeitet oder incentiviert Bewertungen nicht.
Was ist Retatrutide?
Retatrutide ist ein investigativer Dreifach-Agonist, der gleichzeitig drei Hormonrezeptoren aktiviert:
GLP-1-Rezeptor
Glucagon-Like Peptide-1. Verlangsamt die Magenentleerung und reduziert den Appetit.
GIP-Rezeptor
Glukoseabhaengiges insulinotropes Polypeptid. Kann die Insulinantwort verbessern.
Glukagon-Rezeptor
Erhoeht den Energieverbrauch durch Stimulation der hepatischen Glukoseproduktion und Fettoxidation.
Durch die Aktivierung aller drei Signalwege unterscheidet sich Retatrutide von:
- •Semaglutide (nur GLP-1; vermarktet als Ozempic und Wegovy)
- •Tirzepatide (dualer GLP-1- und GIP-Agonist; vermarktet als Mounjaro)
Dieser dreifache Mechanismus erklaert, warum Forscher Retatrutide fuer Adipositas und Stoffwechselerkrankungen untersuchen.
Retatrutide vs Semaglutide
Waehrend Semaglutide (Ozempic, Wegovy) nur den GLP-1-Rezeptor aktiviert, aktiviert Retatrutide GLP-1-, GIP- und Glukagon-Rezeptoren. In Phase-2-Studien erreichte Retatrutide bis zu 24,2 % mittlere Gewichtsreduktion im Vergleich zu etwa 15 % bei Semaglutide in STEP-Studien. Direkte Vergleichsstudien sind jedoch noch nicht veroeffentlicht.
Den vollstaendigen Retatrutide vs Semaglutide Vergleich lesenRetatrutide vs Tirzepatide: Dreifach- vs Dualwirkung
Tirzepatide (Mounjaro) stellt einen bedeutenden Fortschritt mit seinem dualen GLP-1/GIP-Mechanismus dar, aber Retatrutide fuegt einen dritten Signalweg hinzu: die Glukagon-Rezeptor-Aktivierung. In Studien erreichte Retatrutide 24,2 % vs. ca. 22,5 % mittlere Gewichtsreduktion bei Tirzepatide. Forscher glauben, dass die Glukagon-Komponente zur hoeheren Gewichtsreduktion beitraegt.
Den vollstaendigen Retatrutide vs Tirzepatide Vergleich lesen| Merkmal | Retatrutide | Tirzepatide | Semaglutide |
|---|---|---|---|
| GLP-1-Agonist | Ja | Ja | Ja |
| GIP-Agonist | Ja | Ja | Nein |
| Glukagon-Agonist | Ja | Nein | Nein |
| Hoechste mittlere Gewichtsreduktion (Studie) | 24,2 % | ~22,5 % | ~15 % |
Quellen: NEJM Retatrutide 2023, NEJM Tirzepatide 2022 (SURMOUNT-1), NEJM Semaglutide 2021 (STEP 1)
Wie wirkt Retatrutide?
Retatrutide wirkt durch die Aktivierung von drei Hormonrezeptoren, die Appetit und Stoffwechsel regulieren.
GLP-1-Aktivierung
Reduziert Hunger und verlangsamt die Magenentleerung.
GIP-Aktivierung
Verbessert die Insulinausschuettung als Reaktion auf Mahlzeiten.
Glukagon-Aktivierung
Erhoeht den Energieverbrauch.
Diese kombinierte Signalgebung reduziert die Kalorienaufnahme und erhoeht den Energieverbrauch. Die Glukagon-Komponente unterscheidet Retatrutide von dualen Agonisten. Forscher glauben, dass dieser Glukagon-Signalweg zur hoeheren Gewichtsreduktion in Studien beitraegt.
Retatrutide-Dosierung in Studien
Klinische Studien verwendeten eine schrittweise woechentliche Dosissteigerung. Teilnehmer begannen typischerweise mit einer niedrigen Dosis (z. B. 1 mg woechentlich). Forscher erhoehten die Dosis alle vier Wochen bis zum Erreichen einer Zieldosis von 8 mg oder 12 mg. Vollstaendige Dosierungsanleitung.
Startdosis zur Koerperanpassung und Reduktion von GI-Nebenwirkungen
Schrittweise Steigerung reduziert gastrointestinale Nebenwirkungen
Hoechste in Studien untersuchte Erhaltungsdosen
Wichtige Dosierungshinweise
- Einmal woechentlich subkutan verabreicht
- Schrittweise Steigerung reduzierte fruehe Unvertraeglichkeit
- Schnelle Eskalation erhoehte Uebelkeit und Abbruchrate
- Pen bei 2-8 C lagern
- Pen vor der Injektion auf Raumtemperatur bringen
- Injektion in Bauch, Oberschenkel oder Oberarm
Vorteile und Einschraenkungen
Berichtete Vorteile in Studien
- Signifikante Gewichtsreduktion im Vergleich zu Placebo
- Verbesserungen des HbA1c bei Teilnehmern mit Typ-2-Diabetes
- Dosisabhaengige Appetitunterdrueckung
Einschraenkungen und Risiken
- Gastrointestinale Nebenwirkungen nehmen mit der Dosis zu
- Langzeit-Daten zu kardiovaskulaeren Ergebnissen stehen noch aus
- Retatrutide ist in der EU nicht zugelassen
Eine ausgewogene Bewertung ist wichtig. Waehrend die Gewichtsreduktion die Durchschnittswerte der Semaglutide-Studien (~15 % in STEP-Studien) uebertraf, sind direkte Vergleichsstudien noch nicht veroeffentlicht.
Wo kann man Retatrutide in Europa kaufen?
Retatrutide ist in der EU weiterhin investigativ. Kaeufer sollten den aktuellen regulatorischen Status vor dem Kauf verstehen.
Chargengetestete Pens
Jede Charge unabhaengig auf Qualitaet getestet
EU-Versand
Versand innerhalb Europas mit sicherer Verpackung
Analysezertifikat
Analysezertifikat pro Charge enthalten
Sicherer Checkout
Sichere Zahlungsabwicklung
Preise richten sich nach Herstellungscharge und Staerke und werden regelmaessig aktualisiert. Aktuelle Preise finden Sie im Produktbereich (Stand: 19. Februar 2026).
Haeufig gestellte Fragen
Ist Retatrutide dasselbe wie Ozempic?
Nein. Ozempic enthaelt Semaglutide, einen reinen GLP-1-Rezeptor-Agonisten. Retatrutide aktiviert GLP-1-, GIP- und Glukagon-Rezeptoren.
Ist Retatrutide in der EU zugelassen?
Nein. Stand 19. Februar 2026 hat die EMA Retatrutide nicht fuer die Routineverschreibung zugelassen.
Warum erregt Retatrutide Aufmerksamkeit?
Retatrutide erzielte in Phase-2-Studien eine hoehere mittlere Gewichtsreduktion im Vergleich zu frueheren GLP-1-Wirkstoffen. Jedoch muessen groessere und laengere Studien Dauer und Sicherheit bestaetigen.
Abschliessende Ueberlegungen vor dem Kauf
Retatrutide zeigt starke Phase-2-Wirksamkeit. Es bleibt jedoch investigativ und traegt gastrointestinale Nebenwirkungen. Die regulatorische Zulassung steht aus. Kaeufer sollten sowohl Vorteile als auch Risiken vor dem Kauf verstehen.
Produktstaerke pruefen, regulatorisches Verstaendnis bestaetigen und sicher auschecken.
Weiterfuehrende Lektuere
Hilfe beim Kauf von Retatrutide?
Fuer Vergleichs- und Dosierungsinformationen erkunden Sie unsere ausfuehrlichen Anleitungen vor der Bestellung.
Retatrutide bei Veyvora kaufen
Kostenloser EU-Versand | Chargendokumentation enthalten